Ciencia > Química > Coloides > Preparación de Coloides
En este artículo, estudiaremos diferentes métodos de preparación de coloides.
Preparación de Soles liofílicos:
Para la preparación de soles liofílicos, la fase dispersa se agrega directamente al medio de dispersión en frío o por calentamiento.
Soluciones coloidales de almidón, cola, gelatina, etc. en el agua se puede preparar por este método. También se pueden preparar soluciones de electrolitos coloidales, como jabones y colorantes, mediante este método.
Preparación de Soles liofóbicos:
Para preparar soles liofóbicos, la sustancia a granel se descompone en partículas de dimensiones coloidales (Dispersión) o se agregan partículas más pequeñas en partículas de dimensiones coloidales (condensación). Para mejorar la estabilidad del sol, se agregan ciertas sustancias al sol, las sustancias agregadas se denominan estabilizadores.
Métodos de dispersión:
En el método de dispersión, las partículas de mayor tamaño se desglosan hasta el tamaño coloidal en el medio de dispersión. Comenzando con el material en forma masiva, se prepara una solución coloidal utilizando dispositivos adecuados para desintegrarla en partículas de tamaño coloidal. Normalmente esto se lleva a cabo por métodos físicos.
Método de dispersión mecánica :
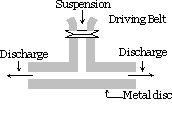
La sustancia que se va a dispersar está finamente molida. Luego se mezcla con el medio de dispersión, también se agregan materiales protectores o estabilizadores cuando se obtiene una suspensión gruesa. Esta suspensión se pasa a través de un molino coloidal. Un molino coloidal consta de dos discos de metal pesado colocados uno encima del otro separados por un espacio muy pequeño entre sí. Se giran en direcciones opuestas a una velocidad muy alta de aproximadamente 7000 rpm. El sol resulta debido al gran efecto de corte. El material protector utilizado evita que las partículas se coagulen.
Utilizando este método sols de índigo, azufre,pasta de dientes, tinta de impresora, pinturas, ungüentos, etc. están preparados.
Dispersión Eléctrica o Método de Arco de Bredig:
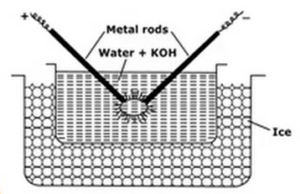
Este método se utiliza para preparar soles metálicos como platino, plata, oro, cobre en agua. Se toma un medio de dispersión (agua conductiva) y una traza de hidróxido de sodio (el agente estabilizador) en un recipiente de porcelana o vidrio (no conductor). El recipiente que contiene el medio de dispersión está rodeado por una mezcla de congelación. El metal a dispersar se sumerge en el recipiente en forma de electrodos. Los electrodos están conectados a la fuente de alto voltaje. Los extremos de los electrodos en el medio de dispersión están muy cerca unos de otros. Se aplica un voltaje muy alto y luego se golpea un arco eléctrico entre las puntas de los electrodos. Esto crea un gran calor debido al cual las varillas de metal se funden, se evaporan y se enfrían repentinamente debido a la mezcla de congelación da lugar a la solución coloidal del metal.
Las funciones de las mezclas de congelación son
- La mezcla de congelación ayuda a la condensación de vapores metálicos que forman los coloides
- Evita la vaporización del agua.
- Previene la coagulación de los coloides, manteniendo el sol frío.
Pepetización o Dispersión química:
La redispersión del precipitado recién preparado en el sol mediante la adición de un electrolito que contiene iones comunes se denomina pepetización. Un electrolito utilizado para la peptización se llama agente peptizante. La peptización es un proceso inverso de coagulación. La acción de peptización se debe a la adsorción preferencial de uno de los iones del electrolito en el precipitado.
Ejemplo-1:
Precipitado de Fe(OH)3 recién preparado cuando se trata con solución diluida de FeCl3, se forma sol de hidróxido férrico marrón rojizo (Fe3+ es ion común). En este caso, FeCl3 es el agente peptizante.
Fe (OH)3 + FeCl3 → Fe3+
Ejemplo – 2:
Precipitado fresco de cloruro de plata cuando se trata con una pequeña cantidad de HCl diluido, se forma un sol de cloruro de plata.
Ejemplo – 3:
El sulfato de cadmio se puede peptizar con la ayuda de sulfato de hidrógeno.Dispersión ultrasónica
:
El ultrasonido es un método de procesamiento muy efectivo en la generación y aplicación de partículas de tamaño coloidal. Para ello se utilizan ondas ultrasónicas de alta intensidad. Durante la sonicación de líquidos, las ondas ultrasónicas que se propagan a través del medio de dispersión producen ciclos alternos de alta presión (compresión) y baja presión (rarefacción). Este estrés mecánico causa cavitación ultrasónica en líquidos. Crea chorros de líquido de alta velocidad de hasta 1000 km / h. Dichos chorros presionan el líquido a alta presión entre las partículas y las separan entre sí. Las partículas más pequeñas se aceleran con los chorros de líquido y chocan a altas velocidades.
Diversas sustancias como aceites, mercurio, azufre, sulfuros y óxidos metálicos pueden dispersarse en estado coloidal mediante este método.
Métodos de condensación:
Estos métodos implican reacciones químicas. En estos métodos factores como la temperatura, la presión, las concentraciones. sucesivamente. se mantienen correctamente. Los iones no deseados presentes en el sol se eliminan por diálisis , ya que estos iones eventualmente pueden coagular el sol.
Métodos químicos:
Método de oxidación:
Preparación de azufre coloidal:
Cuando el H2S en agua (solución acuosa) se expone al aire, se oxida lentamente a azufre. El azufre así formado permanece en el agua en estado coloidal y la solución así formada permanece en el agua en estado coloidal y la solución tiene un aspecto ligeramente lechoso.
H2S + O2 → H2O + 2S (coloidal)
También se puede preparar un sol de azufre cuando el gas H2S burbujea a través de una solución acuosa de SO2.
H2S + SO2 → 2 H2O + 3S (coloidal)
Método de reducción:
Preparación de Sol de oro:
Se pueden obtener varios metales como plata, oro, platino, mercurio, plomo en estado coloidal mediante la reducción de sus soluciones salinas (diluidas) utilizando agentes reductores adecuados como sulfuro de hidrógeno, formaldehído, cloruro estannoso, ácido tánico etc.
Se puede obtener sol de oro cuando la solución de AuCl3(dil) se trata con cloruro de estaño.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (coloidal)
Del mismo modo, se preparan soles de mercurio de plata y platino.
AgNO3 + Ácido tánico → Ag sol
AuCl3 + Ácido tánico → Au sol
Método de hidrólisis:
Preparación de Hidróxido férrico Sol:
Se obtiene una solución coloidal de hidróxido férrico hirviendo una solución diluida de cloruro férrico.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
Preparación de Sol de ácido Silícico:
Por hidrólisis de una solución diluida de silicato de sodio con un ácido clorhídrico, se obtiene la solución coloidal de ácido silícico.
Método de descomposición doble:
Preparación de Sulfuro arsenioso Sol:
Sulfuro arsenioso, As2S3 es un coloide liofóbico. Se obtiene por hidrólisis de óxido arsenioso (AS203) con agua destilada hirviendo, seguida de pasar gas H2S a través de la solución obtenida. En la solución coloidal de sulfuro arsenioso, cada partícula está rodeada de iones HS, producidos por la disociación de H2S. Esta capa de iones de sulfuro está rodeada por la capa de iones contrarios de iones H+.
As2O3 + 3 H2O → 2As(OH)3 (punto de ebullición)
2 As(OH)3 + 3H2S → As2S3 + 6H2O
(sol amarillo claro)
Por Método de intercambio de disolventes:
Hay una serie de sustancias cuyas soluciones coloidales se pueden preparar tomando un solución de la sustancia en un disolvente y vertido en otro disolvente en el que la sustancia es relativamente menos soluble.
Preparado de Sol Sulfuroso o fosforado:
Si se vierte en agua una solución de azufre o fósforo preparada en alcohol, se obtiene una solución coloidal de azufre o fósforo debido a la baja solubilidad del azufre o el fósforo en el agua.
Por cambio de estado físico:
Se obtiene una solución coloidal de determinados elementos, como el mercurio y el azufre, pasando sus vapores a través de agua fría que contiene un estabilizador ( una sal de amonio o un citrato).
Método de Enfriamiento Excesivo:
Se puede preparar una solución coloidal de hielo en un disolvente orgánico como éter o cloroformo congelando una solución de agua en el disolvente. Las moléculas de agua que ya no se pueden mantener en solución, se combinan por separado para formar partículas de tamaño coloidal.
Purificación de Solución Coloidal
Diálisis:
El proceso de separación de las partículas de coloides de las de cristaloides, mediante difusión a través de una membrana adecuada (membrana animal o papel pergamino) se denomina diálisis. El aparato utilizado para la realización de la diálisis se llama dializador.
Principio:
Las partículas coloidales no pueden pasar a través de un pergamino o membrana de celofán, mientras que los iones del electrolito (cristaloides) pueden pasar a través de él.
Proceso:
Una bolsa compuesta de una membrana semipermeable adecuada que contiene la solución coloidal se suspende en un recipiente a través del cual se transporta continuamente agua dulce. Las moléculas y los iones de los cristaloides se difunden a través de la membrana en el agua y se lavan. Así se purifica el sol en la bolsa.
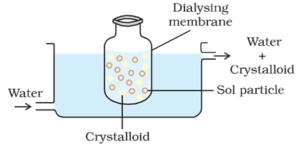
La diálisis se puede utilizar para eliminar el HCl del hidróxido férrico sol.
Electrodiálisis:
El proceso ordinario de diálisis es lento. (ii) Para aumentar el proceso de purificación, la diálisis se realiza mediante la aplicación de un campo eléctrico. Este proceso se denomina electrodiálisis. Los iones presentes en la solución coloidal migran hacia electrodos con carga opuesta.

La aplicación importante del proceso de electrodiálisis en la máquina renal artificial utilizada para la purificación de la sangre de los pacientes cuyos riñones no han funcionado.
Ultrafiltración:
Los poros del papel de filtro ordinario son grandes, por lo que las partículas coloidales pasan a través de ellos fácilmente. Si los poros del papel de filtro ordinario se reducen empapando el papel de filtro en una solución de gelatina de coloidión (es una mezcla de nitrocelulosa al 4% en alcohol y éter) y posteriormente se endurece empapando en formaldehído
, el papel de filtro tratado puede retener partículas coloidales y permitir que las partículas de solución verdadera escapen. Dicho papel de filtro se conoce como ultrafiltro y el proceso de separación de coloides mediante el uso de ultrafiltros se conoce como ultrafiltración.
Las partículas coloidales que quedan en el papel ultrafiltro se lavan con un medio de dispersión fresco para obtener una solución coloidal pura.
Ultracentrifugación:
En este método, la solución coloidal se coloca en una máquina centrífuga de alta velocidad. En la centrifugación, las partículas coloidales se asientan. Las impurezas permanecen en la centrifugadora y se eliminan. Las partículas coloidales sedimentadas se mezclan con el medio de dispersión para formar de nuevo la solución coloidal.