Science > Chimie > Colloïdes > Préparation des Colloïdes
Dans cet article, nous étudierons différentes méthodes de préparation des colloïdes.
Préparation des Sols lyophiles :
Pour la préparation du sol lyophile, la phase dispersée est directement ajoutée au milieu de dispersion à froid ou par réchauffement.
Solutions colloïdales d’amidon, de colle, de gélatine, etc. dans l’eau peut être préparé par cette méthode. Des solutions d’électrolytes colloïdaux tels que des savons et des colorants peuvent également être préparées par cette méthode.
Préparation des Sols lyophobes:
Pour préparer le sol lyophobe, la substance en vrac est décomposée en particules de dimensions colloïdales (Dispersion) ou en agrégeant des particules plus petites en particules de dimensions colloïdales (condensation). Pour améliorer la stabilité du sol, certaines substances sont ajoutées au sol, les substances ajoutées sont appelées stabilisants.
Méthodes de dispersion:
Dans la méthode de dispersion, les particules de plus grande taille sont décomposées à la taille colloïdale dans le milieu de dispersion. À partir du matériau sous forme massive, une solution colloïdale est préparée en utilisant des dispositifs appropriés pour la désintégrer en particules de taille colloïdale. Normalement, cela est effectué par des méthodes physiques.
Méthode de dispersion mécanique :
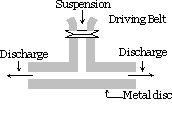
La substance à disperser est finement broyée. Il est ensuite mélangé au milieu de dispersion, des matériaux protecteurs ou stabilisants sont également ajoutés lorsqu’une suspension grossière est obtenue. Cette suspension est ensuite passée dans un broyeur colloïdal. Un broyeur colloïdal se compose de deux disques de métaux lourds placés l’un au-dessus de l’autre séparés par un très petit espace l’un de l’autre. Ils sont tournés dans les directions opposées à une vitesse très élevée d’environ 7000 tr / min. Le sol résulte de l’effet de cisaillement important. Le matériau de protection utilisé empêche les particules de coaguler.
En utilisant cette méthode, des sols d’indigo, de soufre, de dentifrice, d’encre d’imprimante, de peintures, d’onguents, etc. sont préparés.
Dispersion électrique ou Méthode de l’Arc de Bredig:
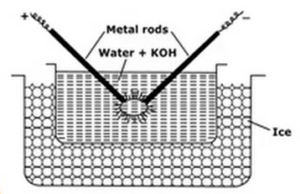
Cette méthode utilisée pour préparer des sols métalliques comme le platine, l’argent, l’or, le cuivre dans l’eau. Un milieu de dispersion (eau de conductivité) et une trace d’hydroxyde de sodium (l’agent stabilisant) sont prélevés dans un récipient en porcelaine ou en verre (non conducteur). Le récipient contenant du milieu de dispersion est entouré d’un mélange de congélation. Le métal à disperser est plongé dans le récipient sous forme d’électrodes. Les électrodes sont connectées à la source haute tension. Les extrémités des électrodes dans le milieu de dispersion sont très proches les unes des autres. Une très haute tension est appliquée puis un arc électrique est frappé entre les pointes des électrodes. Cela crée une chaleur importante à cause de laquelle les tiges de métal fondent, s’évaporent et se refroidissent soudainement en raison du mélange de congélation qui donne naissance à la solution colloïdale du métal.
Les fonctions des mélanges de congélation sont
- Le mélange de congélation aide à la condensation des vapeurs métalliques formant les colloïdes
- Il empêche la vaporisation de l’eau.
- Il empêche la coagulation des colloïdes, en maintenant sol froid.
Peptisation ou dispersion chimique:
La redispersion du précipité fraîchement préparé dans le sol par ajout d’un électrolyte contenant un ion commun est appelée peptisation. Un électrolyte utilisé pour la peptisation est appelé agent peptisant. La peptisation est un processus inverse de coagulation. L’action de peptisation est due à l’adsorption préférentielle de l’un des ions de l’électrolyte sur le précipité.
Exemple 1:
Précipité de Fe(OH)3 fraîchement préparé lorsqu’il est traité avec une solution diluée de FeCl3, un sol d’hydroxyde ferrique brun rougeâtre se forme (Fe3+ étant l’ion commun). Dans ce cas, FeCl3 est l’agent peptidique.
Fe(OH)3 + FeCl3 → Fe3 +
Exemple 2:
Précipité de chlorure d’argent frais lorsqu’il est traité avec une petite quantité d’HCl dilué, un sol de chlorure d’argent se forme.
Exemple – 3:
Le sulfate de cadmium peut être peptisé à l’aide de sulfate d’hydrogène.
Dispersion ultrasonique:
L’échographie est une méthode de traitement très efficace pour la génération et l’application de particules de taille colloïdale. Des ondes ultrasonores de haute intensité sont utilisées à cette fin. Pendant la sonication des liquides, les ondes ultrasonores qui se propagent à travers le milieu de dispersion entraînent une alternance de cycles haute pression (compression) et basse pression (raréfaction). Cette contrainte mécanique provoque une cavitation ultrasonique dans les liquides. Il crée des jets de liquide à grande vitesse allant jusqu’à 1000 km / h. De tels jets pressent le liquide à haute pression entre les particules et les séparent les unes des autres. Les particules plus petites sont accélérées avec les jets de liquide et entrent en collision à grande vitesse.
Diverses substances telles que les huiles, le mercure, le soufre, les sulfures et les oxydes de métal peuvent être dispersées à l’état colloïdal par cette méthode.
Méthodes de condensation:
Ces méthodes impliquent des réactions chimiques. Dans ces méthodes, des facteurs tels que la température, la pression, les concentrations. etc. sont correctement entretenus. Les ions indésirables présents dans le sol sont éliminés par dialyse, car ces ions peuvent éventuellement coaguler le sol.
Méthodes chimiques:
Méthode d’oxydation:
Préparation du soufre colloïdal:
Lorsque le H2S dans l’eau (solution aqueuse) est exposé à l’air, il s’oxyde lentement en soufre. Le soufre ainsi formé reste dans l’eau à l’état colloïdal et la solution ainsi formée reste dans l’eau à l’état colloïdal et la solution présente un aspect légèrement laiteux.
H2S + O2 → H2O + 2S (colloïdal)
Un sol de soufre peut également être préparé lorsque le gaz H2S est bouillonné dans une solution aqueuse de SO2.
H2S + SO2 → 2 H2O + 3S (colloïdal)
Méthode de réduction:
Préparation du sol d’or:
Un certain nombre de métaux comme l’argent, l’or, le platine, le mercure plomb peuvent être obtenus à l’état colloïdal par la réduction de leurs solutions salines (diluées) en utilisant des agents réducteurs appropriés comme le sulfure d’hydrogène, le formaldéhyde, le chlorure stanneux, l’acide tannique etc .
Le sol d’or peut être obtenu lorsque la solution d’AuCl3 (dil) est traitée avec du chlorure stanneux.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (colloïdal)
De même, on prépare des sols d’argent, de platine et de mercure.
AgNO3 + Acide tannique → Sol Ag
AuCl3 + Acide tannique → Sol Au
Méthode d’hydrolyse:
Préparation du Sol d’hydroxyde ferrique:
Une solution colloïdale d’hydroxyde ferrique est obtenue en faisant bouillir une solution diluée de chlorure ferrique.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
Préparation du Sol d’acide silicique:
Par hydrolyse d’une solution diluée de silicate de sodium avec un acide chlorhydrique, on obtient la solution colloïdale d’acide silicique.
Méthode de double décomposition:
Préparation du sulfure arsénieux Sol:
Sulfure arsénieux, As2S3 est un colloïde lyophobe. Il est obtenu par hydrolyse de l’oxyde arsénieux (AS203) avec de l’eau distillée bouillante, suivie du passage du gaz H2S dans la solution obtenue. Dans la solution colloïdale de sulfure arsénieux, chaque particule est entourée d’ions HS, produits par la dissociation de H2S. Cette couche d’ions sulfures est en outre entourée par la couche contre-ionique d’ions H+.
As2O3 + 3 H2O → 2As (OH) 3 (ébullition)
2 As (OH) 3 + 3H2S → As2S3 + 6H2O
(sol jaune clair)
Par Méthode de solvant d’échange:
Il existe un certain nombre de substances dont les solutions colloïdales peuvent être préparées en prenant un solvant solution de la substance dans un solvant et coulée dans un autre solvant dans lequel la substance est relativement moins soluble.
Préparation de Sol de Soufre ou de Phosphore:
Si une solution de soufre ou de phosphore préparée dans l’alcool est versée dans l’eau, une solution colloïdale de soufre ou de phosphore est obtenue en raison de la faible solubilité du soufre ou du phosphore dans l’eau.
Par changement d’état physique :
On obtient une solution colloïdale de certains éléments tels que le mercure et le soufre en faisant passer leurs vapeurs dans de l’eau froide contenant un stabilisant (un sel d’ammonium ou un citrate).
Méthode de refroidissement excessive:
Une solution colloïdale de glace dans un solvant organique comme l’éther ou le chloroforme peut être préparée en congelant une solution d’eau dans le solvant. Les molécules d’eau qui ne peuvent plus être maintenues en solution se combinent séparément pour former des particules de taille colloïdale.
Purification de Solution colloïdale
Dialyse:
Le processus de séparation des particules de colloïde de celles de cristalloïde, par diffusion à travers une membrane appropriée (membrane animale ou papier parchemin) est appelé dialyse. L’appareil utilisé pour effectuer la dialyse est appelé dialyseur.
Principe:
Les particules colloïdales ne peuvent pas traverser une membrane de parchemin ou de cellophane alors que les ions de l’électrolyte (cristalloïdes) peuvent la traverser.
Procédé:
Un sac constitué d’une membrane semi-perméable appropriée contenant la solution colloïdale est suspendu dans un récipient à travers lequel de l’eau douce est transportée en continu. Les molécules et les ions des cristalloïdes diffusent à travers la membrane dans l’eau et sont emportés. Ainsi, le sol dans le sac est purifié.
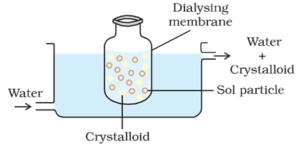
La dialyse peut être utilisée pour éliminer l’HCl du sol d’hydroxyde ferrique.
Électrodialyse:
Le processus ordinaire de dialyse est lent. (ii) Pour augmenter le processus de purification, la dialyse est réalisée en appliquant un champ électrique. Ce processus est appelé électrodialyse. Les ions présents dans la solution colloïdale migrent vers des électrodes chargées de manière opposée.

L’application importante du processus d’électrodialyse dans la machine rénale artificielle utilisée pour la purification du sang des patients dont les reins n’ont pas fonctionné.
Ultrafiltration:
Les pores du papier filtre ordinaire sont grands, donc les particules colloïdales les traversent facilement. Si les pores du papier filtre ordinaire sont réduits par trempage du papier filtre dans une solution de gélatine de colloïde (il s’agit d’un mélange de 4% de nitro-cellulose dans de l’alcool et de l’éther) puis durcis par trempage dans du formaldéhyde
Le papier filtre traité peut retenir des particules colloïdales et permettre aux particules de solution véritable de s’échapper. Un tel papier filtre est connu sous le nom d’ultrafiltre et le processus de séparation des colloïdes à l’aide d’ultrafiltres est connu sous le nom d’ultrafiltration.
Les particules colloïdales laissées sur du papier ultrafiltre sont ensuite lavées avec un milieu de dispersion frais pour obtenir une solution colloïdale pure.
Ultracentrifugation:
Dans cette méthode, la solution colloïdale est placée dans une machine centrifuge à grande vitesse. Lors de la centrifugation, les particules colloïdales se déposent. Les impuretés restent dans le centrifugat et sont éliminées. Les particules colloïdales décantées sont mélangées au milieu de dispersion pour former à nouveau la solution colloïdale.