Vitenskap > Kjemi > Kolloider> Fremstilling Av Kolloider
i denne artikkelen skal vi studere forskjellige metoder for fremstilling av kolloider.
Fremstilling Av Lyofile Soler:
for fremstilling av lyofil sol tilsettes den dispergerte fasen direkte til dispersjonsmedium i kulde eller ved oppvarming.
Kolloidale løsninger av stivelse, lim, gelatin, etc. i vann kan fremstilles ved denne metoden. Løsninger av kolloidale elektrolytter som såper og fargestoffer kan også fremstilles ved denne metoden.
Fremstilling Av Lyofobiske Soler:
for fremstilling av lyofobisk sol brytes stoffet i bulk ned i partikler med kolloidale dimensjoner (Dispersjon) eller aggregering av mindre partikler i partikler med kolloidale dimensjoner (kondensering). For å forbedre stabiliteten til sol tilsettes visse stoffer til sol, de tilsatte stoffene kalles stabilisatorer.
Dispersjonsmetoder:
i dispersjonsmetoden brytes partikkel av større størrelse ned til kolloidal størrelse i dispersjonsmediet. Fra og med materialet i massiv form fremstilles en kolloidal løsning ved å bruke egnede enheter for å disintegrere den i partikler av kolloidal størrelse. Normalt utføres dette ved fysiske metoder.
Mekanisk dispersjonsmetode :
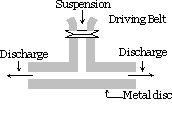
stoffet som skal dispergeres er fint malt. Det blandes deretter med dispersjonsmediet, beskyttende materialer eller stabilisator tilsettes også når en grov suspensjon oppnås. Denne suspensjonen føres deretter gjennom en kolloidmølle. En kolloidmølle består av to tungmetallskiver plassert over hverandre adskilt av et svært lite gap fra hverandre. De roteres i motsatt retning med en svært høy hastighet på ca 7000 rpm sol-resultatene på grunn av den store skjæreffekten. Beskyttende materiale som brukes hindrer partikler fra koagulering.
Ved hjelp av denne metoden sols av indigo, svovel, tannkrem, skriverblekk, maling, salver etc. er forberedt.
Elektrisk Dispersjon eller Bredigs Arc-Metode:
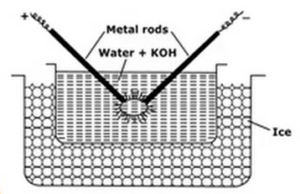
denne metoden brukes til forberedt metall sols som platina, sølv, gull, kobber i vann. Et dispersjonsmedium (konduktivitetsvann) og et spor av natriumhydroksid (stabiliserende middel) tas i porselen eller glass (ikke ledende) beholder. Fartøyet som inneholder dispersjonsmedium er omgitt av en fryseblanding. Metall som skal dispergeres dyppes i karet i form av elektroder. Elektroder er koblet til høyspenningskilden. Endene av elektroder i dispersjonsmediet er svært nær hverandre. En meget høy spenning påføres, og deretter slås en elektrisk lysbue mellom elektrodens spisser. Dette skaper stor varme på grunn som metallstenger smelte, fordampe og plutselig avkjølt på grunn av frysing blandingen gir opphav til kolloidal løsning av metallet.
funksjonene til fryseblandingene er
- Fryseblanding hjelper til med kondensering av metalldamper som danner kolloidene
- det forhindrer fordampning av vann.
- det forhindrer koagulering av kolloider ved å holde sol kaldt.
Peptisering Eller Kjemisk Dispersjon:
Redispersjon av ferskt tilberedt bunnfall i solen ved å legge til en elektrolytt som inneholder vanlig ion kalles peptisering. En elektrolytt som brukes for peptisering kalles som peptizing agent. Peptisering er en omvendt prosess med koagulasjon. Peptiseringsvirkningen skyldes fortrinnsrett adsorpsjon av en av elektrolyttens ioner på bunnfallet.
Eksempel – 1:
ferskt Tilberedt Fe(OH)3 utfelling når det behandles med fortynnet oppløsning Av FeCl3, dannes rødbrun jernhydroksyd sol (Fe3+ er vanlig ion). I Dette tilfellet Er FeCl3 peptizeringsmiddelet.
Fe (OH)3 + FeCl3 → Fe3 +
Eksempel-2:
fersk sølvkloridfelling når det behandles med en liten mengde fortynnet HCl, dannes en sølvkloridsol.
Eksempel – 3:
Kadmiumsulfat kan peptiseres ved hjelp av hydrogensulfat.
Ultralyd Dispersjon:
Ultralyd Er en meget effektiv behandlingsmetode i generering og anvendelse av kolloidale størrelse partikler. Ultralydbølger med høy intensitet brukes til dette formålet. Under sonicating av væsker resulterer ultralydbølgene som forplanter seg gjennom dispersjonsmedium i vekslende høytrykks (kompresjon) og lavtrykks (sjeldnere) sykluser. Dette mekaniske stresset forårsaker Ultralydkavitasjon i væsker. Det skaper høyhastighets væskestråler på opptil 1000 km / t. Slike stråler presser væske ved høyt trykk mellom partiklene og skiller dem fra hverandre. Mindre partikler akselereres med væskestrålene og kolliderer ved høye hastigheter.
Ulike stoffer som oljer, kvikksølv, svovel, sulfider og oksider av metall kan dispergeres i kolloidal tilstand ved denne metoden.
Kondenseringsmetoder:
disse metodene involverer kjemiske reaksjoner. I disse metodene faktorer som temperatur, trykk, konsentrasjoner. osv. er riktig vedlikeholdt. De uønskede ionene som er tilstede i sol fjernes ved dialyse, da disse ionene til slutt kan koagulere sol.
Kjemiske Metoder:
Oksidasjonsmetode:
Fremstilling Av Kolloidal Svovel:
NÅR H2S i vann (vandig oppløsning) utsettes for luft, blir den langsomt oksidert til svovel. Svovelet så dannet forblir i vann i kolloidal tilstand og løsningen så dannet forblir i vann i kolloidal tilstand og løsningen har et litt melkaktig utseende.
H2S + O2 → H2O + 2s (kolloidal)
en sol svovel kan også fremstilles når H2S gass bobles gjennom en vandig OPPLØSNING AV SO2.
H2S + SO2 → 2 H2O + 3s (kolloidal)
Reduksjonsmetode:
Fremstilling Av Gull Sol:
en rekke metaller som sølv, gull, platina, kvikksølv bly kan oppnås i kolloidal tilstand ved reduksjon av deres saltløsninger (fortynnet) ved hjelp av egnede reduksjonsmidler som hydrogensulfid, formaldehyd, klorid, tannsyre etc.
Gull sol kan oppnås når AuCl3(dil) oppløsning er behandlet med stannous klorid.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (kolloidal)
tilsvarende fremstilles sølv, platina kvikksølvsoler.
AgNO3 + Tannsyre → ag sol
AuCl3 + Tannsyre → Au sol
Hydrolysemetode:
Fremstilling Av Jernhydroksid Sol:
en kolloidal oppløsning av jernhydroksid oppnås ved å koke en fortynnet oppløsning av jernklorid.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
Fremstilling Av Kiselsyre Sol:
ved hydrolyse av en fortynnet løsning av natriumsilikat med saltsyre oppnås den kolloidale løsningen av kiselsyre.
Dobbel Dekomponeringsmetode:
Fremstilling Av Arsenisk Sulfid Sol:
Arsenisk sulfid, As2S3 er et lyofobt kolloid. Den oppnås ved hydrolyse av arsenisk oksid(AS203) med kokende destillert vann, etterfulgt AV å passere h2s-gass gjennom oppnådd oppløsning. I den kolloidale løsningen av arsenisk sulfid er hver partikkel omgitt AV HS-ioner, produsert ved dissosiasjon AV H2S. Dette sulfidionlaget er videre omgitt av telleren ionlaget Av H+ – ioner.
As2O3 + 3 h2o → 2as(OH)3 (kokende)
2 As(OH)3 + 3H2S → As2S3 + 6h2o
(lys gul sol)
Ved Utveksling Løsemiddel Metode:
Det finnes en rekke stoffer hvis kolloidale løsninger kan fremstilles ved å ta en løsning av stoffet i ett løsningsmiddel og helles det i et Annet Løsningsmiddel Hvor stoffet ER RELATIVT MINDRE LØSELIG.
Fremstilling Av Svovel-Eller Fosforsol:
hvis en oppløsning av svovel eller fosfor fremstilt i alkohol helles i vann, oppnås en kolloidal oppløsning av svovel eller fosfor på grunn av lav oppløselighet av svovel eller fosfor i vann.
ved endring av fysisk tilstand:
en kolloidal oppløsning av visse elementer som kvikksølv og svovel oppnås ved å føre deres damp gjennom kaldt vann som inneholder en stabilisator ( et ammoniumsalt eller et citrat).
Overdreven Kjølemetode:
en kolloidal oppløsning av is i et organisk løsningsmiddel som eter eller kloroform kan fremstilles ved å fryse en oppløsning av vann i løsningsmidlet. Vannmolekylene som ikke lenger kan holdes i oppløsning, kombineres separat for å danne partikler av kolloidal størrelse.
Rensing Av Kolloidal Oppløsning
Dialyse:
prosessen med å separere partikler av kolloid fra de av krystalloid, ved hjelp av diffusjon gjennom en egnet membran (dyr membran eller pergament papir) kalles dialyse. Apparatet som brukes til å utføre dialyse kalles dialyser.
Prinsipp:
kolloidale partikler kan ikke passere gjennom en pergament eller cellofan membran mens ioner av elektrolytten (krystalloider) kan passere gjennom den.
Prosess:
en pose som består av egnet semipermeabel membran som inneholder kolloidal oppløsning, suspenderes i et fartøy gjennom hvilket ferskvann kontinuerlig fløyet. Molekylene og ionene av krystalloider diffunderer gjennom membranen i vannet og vaskes bort. Dermed blir solen i posen renset.
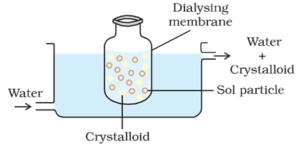
Dialyse kan brukes til å fjerne HCl fra ferrishydroksid sol.
Elektrodialyse:
den vanlige prosessen med dialyse er langsom. (ii) for å øke renseprosessen utføres dialysen ved å påføre et elektrisk felt. Denne prosessen kalles elektrodialyse. Ionene som er tilstede i den kolloidale løsningen migrerer mot motsatt ladede elektroder.

den viktige anvendelsen av elektrodialyseprosessen i den kunstige nyremaskinen som brukes til rensing av blodet til pasientene hvis nyrer ikke har virket.
Ultrafiltrering:
porene i vanlig filterpapir er store, derfor passerer kolloidale partikler lett gjennom dem. Hvis porene i det vanlige filterpapiret gjøres mindre ved å suge filterpapiret i en oppløsning av gelatin av kolloidion (det er en blanding av 4% nitro-cellulose i alkohol og eter) og deretter herdes ved å suge i formaldehyd
, kan det behandlede filterpapiret beholde kolloidale partikler og la de sanne løsningspartiklene unnslippe. Slike filterpapir er kjent som ultrafilter, og prosessen med å separere kolloider ved hjelp av ultrafiltre er kjent som ultrafiltrering.
de kolloidale partiklene igjen på ultrafilterpapir vaskes deretter med et friskt dispersjonsmedium for å få en ren kolloidal løsning.
Ultracentrifugering:
i denne metoden plasseres den kolloidale løsningen i en høyhastighets sentrifugalmaskin. Ved sentrifugering setter de kolloide partiklene seg ned. Urenhetene forblir i sentrifugatet og fjernes. De oppgjorte kolloidale partiklene blandes med dispersjonsmediet for å danne den kolloidale løsningen igjen.