Nauka > Chemia > koloidów > przygotowanie koloidów
w tym artykule zbadamy różne metody wytwarzania koloidów.
przygotowanie soli Liofilowych:
w celu przygotowania soli liofilowej, fazę rozproszoną dodaje się bezpośrednio do ośrodka dyspersyjnego na zimno lub przez ocieplenie.
koloidalne roztwory skrobi, kleju, żelatyny itp. w wodzie można przygotować tą metodą. Roztwory elektrolitów koloidalnych, takich jak mydła i barwniki, można również wytwarzać tą metodą.
przygotowanie zolu Liofobowego:
w celu przygotowania zolu liofobowego substancję luzem rozkłada się na cząstki o wymiarach koloidalnych (Dyspersja) lub agreguje mniejsze cząstki w cząstki o wymiarach koloidalnych (kondensacja). Aby poprawić stabilność zolu niektóre substancje są dodawane do zolu, dodane substancje nazywane są stabilizatorami.
metody dyspersji:
w metodzie dyspersji cząstki o większych rozmiarach są rozkładane na wielkość koloidalną w ośrodku dyspersyjnym. Począwszy od materiału w masywnej formie, roztwór koloidalny przygotowuje się za pomocą odpowiednich urządzeń do rozpadu go na cząstki o wielkości koloidalnej. Zwykle odbywa się to metodami fizycznymi.
metoda mechanicznej dyspersji:
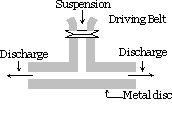
substancja, która ma być rozproszona, jest drobno zmielona. Następnie miesza się go ze środkiem dyspersyjnym, dodaje się również materiały ochronne lub stabilizator, gdy uzyskuje się grubą zawiesinę. Zawiesina ta jest następnie przepuszczana przez młyn koloidalny. Młyn koloidalny składa się z dwóch metalowych krążków umieszczonych jeden nad drugim, oddzielonych od siebie bardzo małą szczeliną. Są one obracane w przeciwnych kierunkach z bardzo dużą prędkością około 7000 rpm. wyniki sol ze względu na duży efekt ścinania. Zastosowany materiał ochronny zapobiega koagulacji cząstek.
stosując tę metodę sols indygo, siarki, pasty do zębów, tuszu do drukarek, farb, maści itp. jesteśmy przygotowani.
Dyspersja elektryczna lub metoda łuku Brediga:
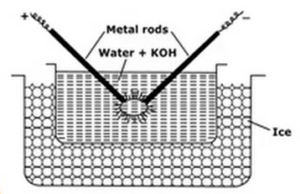
metoda ta stosowana do przygotowania sols metalowych, takich jak platyna, srebro, złoto, miedź w wodzie. Środek dyspersyjny (woda przewodnicza) i ślad wodorotlenku sodu (środek stabilizujący) pobiera się w naczyniu porcelanowym lub szklanym (nieprzewodzącym). Naczynie zawierające czynnik dyspersyjny otoczone jest mieszaniną mrożącą. Rozproszony Metal zanurza się w naczyniu w postaci elektrod. Elektrody są podłączone do źródła wysokiego napięcia. Końce elektrod w ośrodku dyspersyjnym są bardzo blisko siebie. Przyłożone jest bardzo wysokie napięcie, a następnie między końcówkami elektrod uderza łuk elektryczny. Tworzy to duże ciepło, dzięki któremu metalowe pręty topią się, odparowują i nagle ochłodzone z powodu zamarzania mieszaniny powodują powstanie koloidalnego roztworu metalu.
funkcje mieszanek zamrażających to
- mieszanka zamrażająca pomaga w kondensacji oparów metali tworzących koloidy
- zapobiega parowaniu wody.
- zapobiega koagulacji koloidów, utrzymując solę w stanie zimnym.
Peptyzacja lub Dyspersja chemiczna:
Redyspersja świeżo przygotowanego osadu do zolu przez dodanie elektrolitu zawierającego wspólny jon nazywa się peptyzacją. Elektrolit stosowany do peptyzacji nazywany jest środkiem peptyzującym. Peptyzacja jest odwrotnym procesem koagulacji. Działanie peptyzacyjne wynika z preferencyjnej adsorpcji jednego z jonów elektrolitu na osad.
przykład-1:
świeżo przygotowany Fe(OH)3 wytrąca się po potraktowaniu rozcieńczonym roztworem FeCl3, powstaje czerwonobrązowy solowy wodorotlenek żelaza (Fe3+ jest wspólnym Jonem). W tym przypadku czynnikiem peptyzującym jest FeCl3.
Fe (OH)3 + FeCl3 → Fe3+
przykład – 2:
świeży chlorek srebra wytrąca się po potraktowaniu niewielką ilością rozcieńczonego HCl tworzy się sol chlorku srebra.
przykład-3:
siarczan kadmu można peptyzować za pomocą wodorosiarczanu.
Dyspersja ultradźwiękowa:
ultradźwięki są bardzo skuteczną metodą przetwarzania w generowaniu i stosowaniu cząstek koloidalnych. Do tego celu stosuje się fale ultradźwiękowe o wysokiej intensywności. Podczas sonikacji cieczy fale ultradźwiękowe, które propagują się przez medium dyspersyjne, powodują naprzemienne cykle wysokiego ciśnienia (kompresja) i niskiego ciśnienia (rozrzedzenie). To naprężenie mechaniczne powoduje kawitację ultradźwiękową w cieczach. Tworzy szybkie strumienie cieczy o prędkości do 1000 km / h. Takie dysze tłoczą ciecz pod wysokim ciśnieniem między cząstkami i oddzielają je od siebie. Mniejsze cząstki są przyspieszane dyszami cieczy i zderzają się z dużą prędkością.
różne substancje, takie jak oleje, rtęć, Siarka, siarczki i tlenki metali, mogą być rozproszone w stanie koloidalnym za pomocą tej metody.
metody kondensacji:
metody te obejmują reakcje chemiczne. W tych metodach czynniki takie jak temperatura, Ciśnienie, stężenia. itd. są odpowiednio utrzymywane. Niepożądane jony obecne w zolu są usuwane przez dializę , ponieważ jony te mogą ostatecznie koagulować Zol.
metody chemiczne:
metoda utleniania:
przygotowanie siarki koloidalnej:
gdy H2S w wodzie (roztworze wodnym) jest wystawiony na działanie powietrza, powoli utlenia się do siarki. Tak utworzona Siarka pozostaje w wodzie w stanie koloidalnym, a tak utworzony roztwór pozostaje w wodzie w stanie koloidalnym, a roztwór ma lekko mleczny wygląd.
H2S + O2 → H2O + 2S (koloidalny)
można również wytworzyć Zol siarki, gdy gaz H2S jest przepuszczany przez wodny roztwór SO2.
H2S + SO2 → 2 H2O + 3S (koloidalny)
metoda redukcji:
przygotowanie zolu Złota:
wiele metali, takich jak srebro, złoto, platyna, ołów rtęciowy można uzyskać w stanie koloidalnym przez redukcję ich roztworów soli (rozcieńczonych) przy użyciu odpowiednich środków redukujących, takich jak siarkowodór, formaldehyd, chlorek cynowy, kwas garbnikowy itd.
Złoty sol można otrzymać, gdy roztwór AuCl3(dil) jest traktowany chlorkiem cynowym.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (koloidalne)
podobnie przygotowuje się srebrne, Platynowe sola rtęci.
AgNO3 + kwas garbnikowy → Ag sol
AuCl3 + kwas garbnikowy → Au sol
metoda hydrolizy:
przygotowanie wodorotlenku żelaza Sol:
koloidalny roztwór wodorotlenku żelaza otrzymuje się przez gotowanie rozcieńczonego roztworu chlorku żelaza.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
przygotowanie Sol kwasu krzemowego:
poprzez hydrolizę rozcieńczonego roztworu krzemianu sodu kwasem solnym otrzymuje się koloidalny roztwór kwasu krzemowego.
metoda podwójnego rozkładu:
przygotowanie Arsenious Sulfide Sol:
Arsenious sulfide, As2S3 jest koloidem liofobowym. Otrzymuje się go przez hydrolizę tlenku arsenu (AS203) z wrzącą wodą destylowaną, a następnie przepuszczenie gazu H2S przez otrzymany roztwór. W koloidalnym roztworze siarkowodoru każda cząsteczka otoczona jest jonami HS, powstałymi w wyniku dysocjacji H2S. Ta warstwa jonów siarczkowych jest dalej otoczona warstwą przeciwjonów jonów H+.
As2O3 + 3 H2O → 2AS(OH)3 (gotowanie)
2 As(OH)3 + 3h2s → As2S3 + 6H2O
(jasnożółty sol)
metodą rozpuszczalnika wymiennego:
istnieje wiele substancji, których roztwory koloidalne można wytworzyć poprzez roztwór substancji w jednym rozpuszczalniku i wlewanie go do innego rozpuszczalnika, w którym substancja jest stosunkowo mniej rozpuszczalna.
przygotowanie zolu siarki lub fosforu:
jeśli roztwór siarki lub fosforu przygotowany w alkoholu wlewa się do wody, otrzymuje się koloidalny roztwór siarki lub fosforu ze względu na niską rozpuszczalność siarki lub fosforu w wodzie.
przez zmianę stanu fizycznego:
koloidalny roztwór niektórych pierwiastków, takich jak rtęć i siarka, otrzymuje się przez przepuszczenie ich par przez zimną wodę zawierającą stabilizator ( sól amonowa lub cytrynian).
Metoda Nadmiernego Chłodzenia:
koloidalny roztwór lodu w rozpuszczalniku organicznym, takim jak eter lub chloroform, można wytworzyć przez zamrożenie roztworu wody w rozpuszczalniku. Cząsteczki wody, które nie mogą być dłużej utrzymywane w roztworze, oddzielnie łączą się, tworząc cząstki o wielkości koloidalnej.
Oczyszczanie roztworu koloidalnego
Dializa:
proces oddzielania cząstek koloidu od cząstek krystaloidu za pomocą dyfuzji przez odpowiednią membranę (błonę zwierzęcą lub papier pergaminowy) nazywa się dializą. Aparat używany do wykonywania dializy nazywa się dializatorem.
zasada:
cząstki koloidalne nie mogą przejść przez membranę pergaminową lub celofanową, podczas gdy jony elektrolitu (krystaloidy) mogą przez niego przejść.
proces:
worek składający się z odpowiedniej półprzepuszczalnej membrany zawierającej roztwór koloidalny jest zawieszony w naczyniu, przez które stale przepływa świeża woda. Cząsteczki i jony krystaloidów dyfundują przez membranę do wody i są zmywane. W ten sposób sol w worku jest oczyszczany.
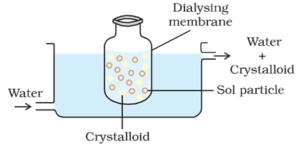
do usunięcia HCl z roztworu wodorotlenku żelaza Zol można zastosować dializę.
Elektrodializa:
zwykły proces dializy jest powolny. (ii) w celu zwiększenia procesu oczyszczania, dializa jest przeprowadzana przez zastosowanie pola elektrycznego. Proces ten nazywany jest elektrodializą. Jony obecne w roztworze koloidalnym migrują w kierunku przeciwstawnie naładowanych elektrod.

ważne zastosowanie procesu elektrodializy w sztucznej maszynie nerkowej stosowanej do oczyszczania krwi pacjentów, których nerki nie działały.
ultrafiltracja:
pory zwykłego papieru filtracyjnego są duże, dlatego cząstki koloidalne łatwo przez nie przechodzą. Jeśli pory zwykłego papieru filtracyjnego są zmniejszone przez namoczenie bibuły filtracyjnej w roztworze żelatyny koloidionu (jest to mieszanina 4% nitrocelulozy w alkoholu i eterze), a następnie utwardzenie przez namoczenie w Formaldehydu
, potraktowany papier filtracyjny może zatrzymywać cząstki koloidalne i umożliwiać ucieczkę prawdziwych cząstek roztworu. Taki papier filtracyjny jest znany jako ultrafilter, a proces oddzielania koloidów za pomocą ultrafiltrów jest znany jako ultrafiltracja.
cząstki koloidalne pozostawione na papierze ultrafiltrowym są następnie przemywane świeżym środkiem dyspersyjnym, aby uzyskać czysty roztwór koloidalny.
Ultracentryfugacja:
w tej metodzie roztwór koloidalny umieszcza się w szybkiej maszynie odśrodkowej. Podczas wirowania cząstki koloidalne osiadają. Zanieczyszczenia pozostają w wirówce i są usuwane. Osadzone cząstki koloidalne miesza się ze środkiem dyspersyjnym, tworząc ponownie roztwór koloidalny.