Scienza > Chimica > Colloidi>Preparazione dei colloidi
In questo articolo, studieremo diversi metodi di preparazione dei colloidi.
Preparazione di Sol liofilici:
Per la preparazione di sol liofilici, la fase dispersa viene aggiunta direttamente al mezzo di dispersione a freddo o riscaldando.
Soluzioni colloidali di amido, colla, gelatina, ecc. in acqua può essere preparato con questo metodo. Soluzioni di elettroliti colloidali come saponi e coloranti possono anche essere preparate con questo metodo.
Preparazione di Sol liofobici:
Per la preparazione di sol liofobici, la sostanza alla rinfusa viene scomposta in particelle di dimensioni colloidali (Dispersione) o aggregando particelle più piccole in particelle di dimensioni colloidali (condensazione). Per migliorare la stabilità del sol alcune sostanze vengono aggiunte al sol, le sostanze aggiunte sono chiamate stabilizzanti.
Metodi di dispersione:
Nel metodo di dispersione le particelle di dimensioni maggiori sono suddivise in dimensioni colloidali nel mezzo di dispersione. A partire dal materiale in forma massiccia, viene preparata una soluzione colloidale utilizzando dispositivi adatti per disintegrarla in particelle di dimensioni colloidali. Normalmente questo viene eseguito con metodi fisici.
Metodo di dispersione meccanica:
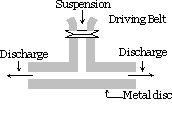
La sostanza che deve essere dispersa è finemente macinata. Viene quindi miscelato con il mezzo di dispersione, vengono aggiunti anche materiali protettivi o stabilizzatori quando si ottiene una sospensione grossolana. Questa sospensione viene quindi fatta passare attraverso un mulino colloidale. Un mulino colloidale è costituito da due dischi di metallo pesante posti uno sopra l’altro separati da uno spazio molto piccolo l’uno dall’altro. Vengono ruotati nelle direzioni opposte ad una velocità molto elevata di circa 7000 giri / min. Il sol risulta dovuto al grande effetto di taglio. Il materiale protettivo utilizzato impedisce la coagulazione delle particelle.
Utilizzando questo metodo sols di indaco, zolfo, dentifricio, inchiostro della stampante,vernici, unguenti ecc. sono preparati.
Dispersione elettrica o metodo dell’arco di Bredig:
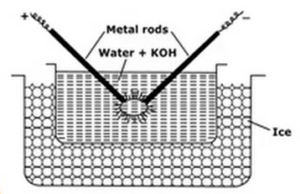
Questo metodo utilizzato per sol metallici preparati come platino, argento, oro, rame in acqua. Un mezzo di dispersione (acqua di conduttività) e una traccia di idrossido di sodio (l’agente stabilizzante) vengono prelevati in recipienti di porcellana o vetro (non conduttori). La nave contenente il mezzo di dispersione è circondata da una miscela di congelamento. Il metallo da disperdere viene immerso nella nave sotto forma di elettrodi. Gli elettrodi sono collegati alla sorgente ad alta tensione. Le estremità degli elettrodi nel mezzo di dispersione sono molto vicine l’una all’altra. Viene applicata una tensione molto alta e quindi viene colpito un arco elettrico tra le punte degli elettrodi. Questo crea grande calore a causa della quale barre di metallo si fondono, evaporare e improvvisamente raffreddato a causa di congelamento miscela dà luogo alla soluzione colloidale del metallo.
Le funzioni delle miscele congelanti sono
- La miscela congelante aiuta nella condensazione dei vapori metallici che formano i colloidi
- Impedisce la vaporizzazione dell’acqua.
- Previene la coagulazione dei colloidi, mantenendo sol freddo.
Peptizzazione o dispersione chimica:
La ridispersione del precipitato appena preparato nel sol aggiungendo un elettrolita contenente ion comune è chiamata peptizzazione. Un elettrolito utilizzato per la peptizzazione è chiamato come agente peptizzante. La peptizzazione è un processo inverso di coagulazione. L’azione di peptizzazione è dovuta all’adsorbimento preferenziale di uno degli ioni dell’elettrolita sul precipitato.
Esempio-1:
Precipitato Fe(OH)3 appena preparato quando trattato con soluzione diluita di FeCl3, si forma idrossido ferrico sol bruno rossastro (Fe3+ è ion comune). In questo caso, FeCl3 è l’agente peptizzante.
Fe (OH)3 + FeCl3 → Fe3+
Esempio – 2:
Precipitato di cloruro d’argento fresco se trattato con una piccola quantità di HCl diluito, si forma un sol di cloruro d’argento.
Esempio – 3:
Il solfato di cadmio può essere peptizzato con l’aiuto dell’idrogeno solfato.
Dispersione ultrasonica:
L’ultrasuono è un metodo di elaborazione molto efficace nella generazione e nell’applicazione delle particelle colloidali di dimensione. Per questo scopo vengono utilizzate onde ultrasoniche ad alta intensità. Durante la sonicazione dei liquidi le onde ultrasoniche che si propagano attraverso il mezzo di dispersione provocano cicli alternati ad alta pressione (compressione) e bassa pressione (rarefazione). Questo stress meccanico provoca cavitazione ultrasonica nei liquidi. Crea getti liquidi ad alta velocità fino a 1000 km/h. Tali getti premono il liquido ad alta pressione tra le particelle e le separano l’una dall’altra. Le particelle più piccole vengono accelerate con i getti di liquido e si scontrano ad alte velocità.
Varie sostanze come oli, mercurio, zolfo, solfuri e ossidi di metallo possono essere disperse allo stato colloidale con questo metodo.
Metodi di condensazione:
Questi metodi comportano reazioni chimiche. In questi metodi fattori come temperatura, pressione, concentrazioni. ecc. sono mantenuti correttamente. Gli ioni indesiderati presenti nel sol vengono rimossi mediante dialisi, poiché questi ioni possono eventualmente coagulare il sol.
Metodi chimici:
Metodo di ossidazione:
Preparazione dello zolfo colloidale:
Quando H2S in acqua (soluzione acquosa) è esposto all’aria, viene lentamente ossidato a zolfo. Lo zolfo così formato rimane in acqua allo stato colloidale e la soluzione così formata rimane in acqua allo stato colloidale e la soluzione ha un aspetto leggermente lattiginoso.
H2S + O2 → H2O + 2S (colloidale)
Un sol di zolfo può anche essere preparato quando il gas H2S viene gorgogliato attraverso una soluzione acquosa di SO2.
H2S + SO2 → 2 H2O + 3S (colloidale)
Metodo di Riduzione:
Preparazione di Sol d’Oro:
Un certo numero di metalli come argento, oro, platino, mercurio piombo può essere ottenuto in colloidale dalla riduzione del loro soluzioni saline (diluito) con opportuni agenti riducenti come l’idrogeno solforato, la formaldeide, il cloruro stannoso, acido tannico, etc.
Gold sol può essere ottenuto quando la soluzione di AuCl3 (dil) viene trattata con cloruro stannoso.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (colloidale)
Allo stesso modo, vengono preparati i sol di mercurio in argento e platino.
AgNO3 + acido Tannico → Ag sol
AuCl3 + acido Tannico → Au sol
Metodo dell’Idrolisi:
Preparazione dell’Idrossido Ferrico Sol:
Una soluzione colloidale di idrossido ferrico è ottenuto dall’ebollizione di una soluzione diluita di cloruro ferrico.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
Preparazione di acido silicico Sol:
Per idrolisi di una soluzione diluita di silicato di sodio con un acido cloridrico, si ottiene la soluzione colloidale di acido silicico.
Metodo di decomposizione doppia:
Preparazione di solfuro arsenioso Sol:
Solfuro arsenioso, As2S3 è un colloide liofobico. Si ottiene per idrolisi dell’ossido arsenioso (AS203) con acqua distillata bollente, seguita dal passaggio del gas H2S attraverso la soluzione ottenuta. Nella soluzione colloidale di solfuro arsenioso, ogni particella è circondata da ioni HS, prodotti dalla dissociazione di H2S. Questo strato di ioni solfuro è ulteriormente circondato dallo strato di ioni contatore di ioni H+.
As2O3 + 3 H2O → 2(OH)3 (punto di ebollizione)
2(OH)3 + 3H2S → As2S3 + 6H2O
(giallo chiaro sol)
Da Exchange Solvente Metodo:
Ci sono un certo numero di sostanze il cui soluzioni colloidali possono essere predisposti adottando una soluzione della sostanza in un solvente e versarlo in un altro solvente in cui la sostanza è relativamente meno solubile.
Preparazione di Sol di zolfo o di fosforo:
Se una soluzione di zolfo o fosforo preparata in alcool viene versata in acqua, si ottiene una soluzione colloidale di zolfo o fosforo a causa della bassa solubilità dello zolfo o del fosforo in acqua.
Per cambiamento di stato fisico:
Una soluzione colloidale di alcuni elementi come mercurio e zolfo si ottiene facendo passare i loro vapori attraverso acqua fredda contenente uno stabilizzatore ( un sale di ammonio o un citrato).
Metodo di raffreddamento eccessivo:
Una soluzione colloidale di ghiaccio in un solvente organico come l’etere o il cloroformio può essere preparata congelando una soluzione di acqua nel solvente. Le molecole di acqua che non possono più essere tenute in soluzione, si combinano separatamente per formare particelle di dimensioni colloidali.
Purificazione della soluzione colloidale
Dialisi:
Il processo di separazione delle particelle di colloide da quelle di cristalloide, mediante diffusione attraverso una membrana adatta (membrana animale o carta pergamena) è chiamato dialisi. L’apparecchio utilizzato per la dialisi è chiamato dialyser.
Principio:
Le particelle colloidali non possono passare attraverso una membrana pergamena o cellophane mentre gli ioni dell’elettrolita (cristalloidi) possono attraversarlo.
Processo:
Un sacchetto costituito da un’idonea membrana semipermeabile contenente la soluzione colloidale è sospeso in un recipiente attraverso il quale l’acqua dolce viene continuamente trasportata. Le molecole e gli ioni dei cristalloidi si diffondono attraverso la membrana nell’acqua e vengono lavati via. Così il sol nella borsa è purificato.
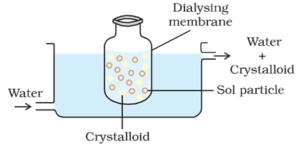
La dialisi può essere utilizzata per rimuovere HCl dall’idrossido ferrico sol.
Elettrodialisi:
Il processo ordinario di dialisi è lento. (ii) Per aumentare il processo di purificazione, la dialisi viene eseguita applicando un campo elettrico. Questo processo è chiamato elettrodialisi. Gli ioni presenti nella soluzione colloidale migrano verso elettrodi caricati in modo opposto.

L’importante applicazione del processo di elettrodialisi nella macchina renale artificiale utilizzata per la purificazione del sangue dei pazienti i cui reni non hanno funzionato.
Ultrafiltrazione:
I pori della normale carta da filtro sono grandi, quindi le particelle colloidali li attraversano facilmente. Se i pori della normale carta da filtro vengono ridotti immergendo la carta da filtro in una soluzione di gelatina di colloidione (è una miscela di nitro-cellulosa al 4% in alcool ed etere) e successivamente indurita immergendo in formaldeide
La carta da filtro trattata può trattenere le particelle colloidali e consentire alle particelle di soluzione vere di fuoriuscire. Tale carta da filtro è nota come ultrafiltro e il processo di separazione dei colloidi utilizzando ultrafiltri è noto come ultrafiltrazione.
Le particelle colloidali lasciate su carta ultrafilter vengono quindi lavate con un mezzo di dispersione fresco per ottenere una soluzione colloidale pura.
Ultracentrifugazione:
In questo metodo, la soluzione colloidale viene collocata in una macchina centrifuga ad alta velocità. Durante la centrifugazione, le particelle colloidali si depositano. Le impurità rimangono nel centrifugato e vengono rimosse. Le particelle colloidali sedimentate vengono mescolate con il mezzo di dispersione per formare nuovamente la soluzione colloidale.