Ciências > Química > Colóides > Preparação de Colóides
neste artigo, vamos estudar diferentes métodos de preparação de colóides.
preparação de Sols Liofílicos:
para a preparação de sol liofílico, a fase dispersa é adicionada diretamente ao meio de dispersão no frio ou pelo aquecimento.
soluções coloidais de amido, cola, gelatina, etc. na água pode ser preparado por este método. Soluções de eletrólitos coloidais, como sabonetes e corantes, também podem ser preparadas por este método.
preparação de Sols Liofóbicos:
para a preparação de sol liofóbico, a substância a granel é decomposta em partículas de dimensões coloidais (dispersão) ou agregando partículas menores em partículas de dimensões coloidais (condensação). Para melhorar a estabilidade do sol, certas substâncias são adicionadas ao sol, as substâncias adicionadas são chamadas de estabilizadores.
Métodos de dispersão:
no método de dispersão, partículas de tamanho maior são divididas até o tamanho coloidal no meio de dispersão. Começando com o material em forma maciça, uma solução coloidal é preparada usando dispositivos adequados para desintegrá-lo em partículas de tamanho coloidal. Normalmente, isso é realizado por métodos físicos.
método de dispersão Mecânica :
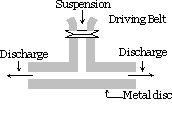
a substância que deve ser dispersa é finamente moída. Em seguida, é misturado com o meio de dispersão, materiais de proteção ou estabilizador também são adicionados quando uma suspensão grossa é obtida. Esta suspensão é então passada através de um moinho colóide. Um moinho colóide consiste em dois discos de metal pesado colocados um acima do outro separados por um espaço muito pequeno um do outro. Eles são girados nas direções opostas a uma velocidade muito alta de cerca de 7000 r. p.m.os resultados do sol devido ao grande efeito de cisalhamento. O material protetor usado impede que as partículas coagulem.
usando este método sols de índigo, enxofre, pasta de dente, tinta de impressora, tintas, pomadas etc. estão preparados.
dispersão elétrica ou Método de Arco de Bredig:
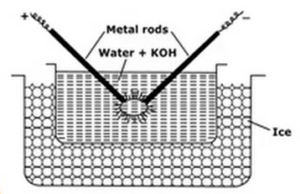
este método usado para sols de metal preparados como platina, prata, ouro, cobre na água. Um meio de dispersão (água de condutividade) e um traço de hidróxido de sódio (o agente estabilizador) são tomados em porcelana ou vaso de vidro (não condutor). O recipiente contendo meio de dispersão é cercado por uma mistura de congelamento. O Metal a ser disperso é mergulhado no vaso na forma de eletrodos. Os eletrodos são conectados à fonte de alta tensão. As extremidades dos eletrodos no meio de dispersão estão muito próximas umas das outras. Uma tensão muito alta é aplicada e, em seguida, um arco elétrico é atingido entre as pontas dos eletrodos. Isso cria um grande calor devido ao qual as hastes de metal derretem, evaporam e de repente esfriam devido à mistura de congelamento que dá origem à solução coloidal do metal.
as funções das misturas de congelação são
- a mistura de congelação ajuda na condensação de vapores metálicos que formam os colóides
- impede a vaporização da água.
- impede a coagulação dos colóides, mantendo o sol frio.
Peptização ou dispersão Química:
Redispersão de precipitado recém-preparado no sol adicionando um eletrólito contendo íon comum é chamado de peptização. Um eletrólito usado para peptização é chamado de agente peptizante. A peptização é um processo reverso de coagulação. A ação de peptização é devida à adsorção preferencial de um dos íons do eletrólito no precipitado.
exemplo-1:
precipitado Fe(OH)3 preparado na hora quando tratado com solução diluída de FeCl3, o hidróxido férrico marrom avermelhado sol é formado (Fe3+ sendo íon comum). Nesse caso, FeCl3 é o agente peptizante.
Fe (OH)3 + FeCl3 → Fe3+
Exemplo-2:
precipitado de cloreto de prata fresco quando tratado com uma pequena quantidade de HCl diluído, um sol de cloreto de prata é formado.
exemplo – 3:
o sulfato de cádmio pode ser peptizado com a ajuda do sulfato de hidrogênio.
dispersão ultra-sônica:
o ultra-som é um método de processamento muito eficaz na geração e aplicação de partículas de tamanho coloidal. Ondas ultrassônicas de alta intensidade são usadas para esse fim. Durante a sonicação de líquidos, as ondas ultrassônicas que se propagam através do meio de dispersão resultam em ciclos alternados de alta pressão (compressão) e baixa pressão (rarefação). Este esforço mecânico causa a cavitação ultrassônica nos líquidos. Cria jatos líquidos de alta velocidade de até 1000km / h. Esses jatos pressionam o líquido a alta pressão entre as partículas e as separam umas das outras. Partículas menores são aceleradas com os jatos líquidos e colidem em altas velocidades.
várias substâncias como óleos, mercúrio, enxofre, sulfetos e óxidos de metal podem ser dispersas em estado coloidal por este método.
Métodos de condensação:
esses métodos envolvem reações químicas. Nestes métodos fatores como temperatura, pressão, concentrações. etc. são devidamente mantidos. Os íons indesejados presentes no sol são removidos por diálise , pois esses íons podem eventualmente coagular o sol.
métodos químicos:
método de oxidação:
preparação de enxofre coloidal:
quando o H2S na água (solução aquosa) é exposto ao ar, ele lentamente é oxidado ao enxofre. O enxofre assim formado permanece na água no estado coloidal e a solução assim formada permanece na água no estado coloidal e a solução tem uma aparência ligeiramente leitosa.
H2S + O2 → H2O + 2S (coloidal)
Um sol de enxofre também pode ser preparado quando H2S do gás é assinalada através de uma solução aquosa de SO2.
H2S + SO2 → 2 H2O + 3S (coloidal)
Método de Redução:
Preparação de Ouro do Sol:
Um número de metais, como a prata, o ouro, a platina, o mercúrio, o chumbo pode ser obtido no estado coloidal pela redução de suas soluções salinas (diluir) uso adequado de agentes redutores, como o sulfureto de hidrogénio, formaldeído, o cloreto estanoso, ácido tânico, etc.
o sol de ouro pode ser obtido quando a solução de AuCl3 (dil) é tratada com cloreto estanoso.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (coloidal)
da mesma forma, prata, platina mercúrio sols são preparados.
AgNO3 + ácido Tânico → Ag sol
AuCl3 + ácido Tânico → Au sol
Método de Hidrólise:
Preparação de Hidróxido Férrico Sol:
Uma solução coloidal de hidróxido férrico é obtido pela ebulição de uma solução diluída de cloreto férrico.
FeCl3 + 3H2O → Fe (OH) 3 + 3 HCl
preparação de ácido silícico Sol:
por hidrólise de uma solução diluída de silicato de sódio com ácido clorídrico, obtém-se a solução coloidal de ácido silícico.
método de decomposição Dupla:
preparação de sulfeto de arsênio Sol:
sulfeto de arsênio, As2S3 é um colóide liofóbico. É obtido pela hidrólise do óxido de arsênio (AS203) com água destilada fervente, seguida pela passagem do gás H2S através da solução obtida. Na solução coloidal de sulfeto de arsênio, cada partícula é cercada por íons HS, produzidos pela dissociação de H2S. Esta camada do íon do sulfureto é cercada mais pela camada contrária do íon de íons de H+.
As2O3 + 3 H2O → 2como(OH)3 (ebulição)
2 Como(OH)3 + 3H2S → As2S3 + 6H2O
(luz amarela do sol)
Por Troca de Solvente Método:
Há uma série de substâncias cuja coloidal soluções podem ser preparadas tomando uma solução da substância em um solvente e despejando-o em outro solvente no qual a substância é relativamente menos solúvel.
preparação de enxofre ou sol de fósforo:
Se uma solução de enxofre ou fósforo preparado em álcool é vertida em água, uma solução coloidal de enxofre ou fósforo é obtido devido à baixa solubilidade de enxofre ou fósforo na água.
por mudança de estado físico:
uma solução coloidal de certos elementos, como mercúrio e enxofre, é obtida passando seus vapores por água fria contendo um estabilizador ( um sal de amônio ou um citrato).
Método De Arrefecimento Excessivo:
uma solução coloidal de gelo em um solvente orgânico como éter ou clorofórmio pode ser preparada congelando uma solução de água no solvente. As moléculas de água que não podem mais ser mantidas em solução, se combinam separadamente para formar partículas de tamanho coloidal.
purificação de solução coloidal
diálise:
o processo de separação das partículas de colóide das de cristalóide, por meio de difusão através de uma membrana adequada (membrana animal ou papel pergaminho) é chamado de diálise. O aparelho usado para a realização de diálise é chamado dialisador.
princípio:
as partículas coloidais não podem passar por uma membrana de pergaminho ou celofane enquanto os íons do eletrólito (cristalóides) podem passar por ela.
processo:
um saco composto por membrana semipermeável adequada contendo a solução coloidal é suspenso em um vaso através do qual a água doce é continuamente transportada. As moléculas e íons de cristalóides se difundem através da membrana na água e são lavados. Assim, o sol no saco é purificado.
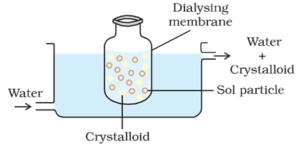
a diálise pode ser usada para remover HCl do hidróxido férrico sol.
eletrodiálise:
o processo ordinário de diálise é lento. (ii) para aumentar o processo de purificação, a diálise é realizada aplicando um campo elétrico. Esse processo é chamado de eletrodiálise. Os íons presentes na solução coloidal migram para eletrodos de carga oposta.

a importante aplicação do processo de eletrodiálise na máquina renal artificial usada para a purificação do sangue dos pacientes cujos rins não funcionaram.
ultrafiltração:
os poros do papel de filtro comum são grandes, portanto partículas coloidais passam facilmente por eles. Se os poros do filtro ordinária de papel são feitos a menor, mergulhando-o filtro de papel em uma solução de gelatina de colloidion (é uma mistura de 4% de nitro-celulose em álcool e éter) e, posteriormente, endurecidos por imersão em formaldeído
O tratado de papel de filtro podem reter partículas coloidais e permitir que a verdadeira solução partículas para escapar. Esse papel de filtro é conhecido como Ultrafiltro e o processo de separação de colóides usando ultrafiltros é conhecido como ultrafiltração.
as partículas coloidais deixadas no papel Ultrafiltro são então lavadas com um meio de dispersão fresco para obter uma solução coloidal pura.
Ultracentrifugação:
neste método, a solução coloidal é colocada em uma máquina centrífuga de alta velocidade. Na centrifugação, as partículas coloidais se instalam. As impurezas permanecem no centrifugador e são removidas. As partículas coloidais assentadas são misturadas com o meio de dispersão para formar novamente a solução coloidal.