Wissenschaft > Chemie > Kolloide > Herstellung von Kolloiden
In diesem Artikel werden wir verschiedene Methoden zur Herstellung von Kolloiden untersuchen.
Herstellung von lyophilen Solen:
Zur Herstellung von lyophilen Solen wird die dispergierte Phase direkt in Kälte oder durch Erwärmen dem Dispersionsmedium zugesetzt.
Kolloidale Lösungen von Stärke, Leim, Gelatine usw. in Wasser kann nach dieser Methode hergestellt werden. Auch Lösungen kolloidaler Elektrolyte wie Seifen und Farbstoffe können nach diesem Verfahren hergestellt werden.
Herstellung von lyophoben Solen:
Zur Herstellung von lyophoben Solen wird die Substanz in loser Schüttung in Partikel kolloidaler Abmessungen zerlegt (Dispersion) oder kleinere Partikel in Partikel kolloidaler Abmessungen aggregiert (Kondensation). Um die Stabilität von Sol zu verbessern, werden dem Sol bestimmte Substanzen zugesetzt, die zugesetzten Substanzen werden Stabilisatoren genannt.
Dispersionsmethoden:
Bei der Dispersionsmethode werden Partikel größerer Größe im Dispersionsmedium auf die kolloidale Größe zerlegt. Ausgehend von dem Material in massiver Form wird eine kolloidale Lösung hergestellt, indem geeignete Vorrichtungen verwendet werden, um es in Partikel kolloidaler Größe aufzulösen. Normalerweise wird dies mit physikalischen Methoden durchgeführt.
Mechanische Dispergiermethode :
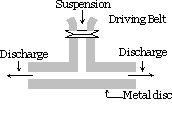
Die zu dispergierende Substanz wird fein gemahlen. Es wird dann mit dem Dispersionsmittel gemischt, Schutzmaterialien oder Stabilisator werden ebenfalls zugegeben, wenn eine grobe Suspension erhalten wird. Diese Suspension wird dann durch eine Kolloidmühle geleitet. Eine Kolloidmühle besteht aus zwei übereinander angeordneten Schwermetallscheiben, die durch einen sehr kleinen Spalt voneinander getrennt sind. Sie werden in entgegengesetzte Richtungen mit einer sehr hohen Geschwindigkeit von etwa 7000 U / min gedreht. Das verwendete Schutzmaterial verhindert die Koagulation von Partikeln.
Mit dieser Methode Sole von Indigo, Schwefel, Zahnpasta, Druckertinte, Farben, Salben usw. vorbereitet sind.
Elektrische Dispersion oder Bredigs Arc-Methode:
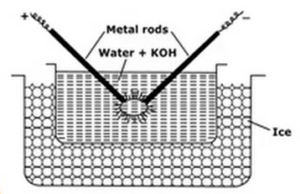
Diese methode verwendet, um vorbereitet metall sole wie platin, silber, gold, kupfer in wasser. Ein Dispersionsmedium (Leitfähigkeitswasser) und eine Spur von Natriumhydroxid (das Stabilisierungsmittel) wird in Porzellan oder Glas (nicht leitend) Gefäß genommen. Das Dispersionsmedium enthaltende Gefäß ist von einem Gefriergemisch umgeben. Das zu dispergierende Metall wird in Form von Elektroden in das Gefäß getaucht. Elektroden sind an die Hochspannungsquelle angeschlossen. Die Enden der Elektroden im Dispersionsmedium liegen sehr nahe beieinander. Eine sehr hohe Spannung wird angelegt und dann wird ein elektrischer Lichtbogen zwischen den Spitzen der Elektroden gezündet. Dies erzeugt große Wärme, aufgrund derer Metallstäbe schmelzen, verdampfen und plötzlich durch Einfrieren Mischung abgekühlt führt zu der kolloidalen Lösung des Metalls.
Funktionen der Gefriermischungen sind
- Gefriermischung hilft bei der Kondensation von Metalldämpfen, die die Kolloide bilden
- Es verhindert die Verdampfung von Wasser.
- Es verhindert die Koagulation von Kolloiden, indem es Sol kalt hält.
Peptisierung oder chemische Dispersion:
Redispergierung von frisch hergestelltem Niederschlag in das Sol durch Zugabe eines Elektrolyten, der ein Ion enthält, wird als Peptisierung bezeichnet. Ein Elektrolyt, der zur Peptisierung verwendet wird, wird als Peptisierungsmittel bezeichnet. Peptisierung ist ein umgekehrter Prozess der Koagulation. Die Peptisierungswirkung beruht auf der bevorzugten Adsorption eines der Ionen des Elektrolyten am Niederschlag.
Beispiel – 1:
Frisch hergestellter Fe (OH) 3-Niederschlag Bei Behandlung mit verdünnter Lösung von FeCl3 entsteht rotbraunes Eisenhydroxidsol (Fe3 + ist übliches Ion). In diesem Fall ist FeCl3 das Peptisierungsmittel.
Fe (OH)3 + FeCl3 → Fe3+
Beispiel – 2:
Frischer Silberchloridniederschlag Bei Behandlung mit einer kleinen Menge verdünnter HCl entsteht ein Silberchloridsol.
Beispiel – 3:
Cadmiumsulfat kann mit Hilfe von Schwefelwasserstoff peptisiert werden.
Ultraschall Dispersion:
Ultraschall ist eine sehr effektive verarbeitung methode in die generation und anwendung von kolloidale größe partikel. Zu diesem Zweck werden hochintensive Ultraschallwellen verwendet. Während der Beschallung von Flüssigkeiten führen die Ultraschallwellen, die sich durch das Dispersionsmedium ausbreiten, zu abwechselnden Hochdruck- (Kompressions-) und Niederdruck- (Verdünnungs-) Zyklen. Diese mechanische Belastung verursacht Ultraschallkavitation in Flüssigkeiten. Es erzeugt Hochgeschwindigkeits-Flüssigkeitsstrahlen von bis zu 1000 km / h. Solche Strahlen drücken Flüssigkeit mit hohem Druck zwischen die Partikel und trennen sie voneinander. Kleinere Partikel werden mit den Flüssigkeitsstrahlen beschleunigt und kollidieren mit hohen Geschwindigkeiten.
Verschiedene Substanzen wie Öle, Quecksilber, Schwefel, Sulfide und Metalloxide können mit diesem Verfahren kolloidal dispergiert werden.
Kondensationsmethoden:
Diese Methoden beinhalten chemische Reaktionen. Bei diesen Methoden Faktoren wie Temperatur, Druck, Konzentrationen. etc. werden ordnungsgemäß gewartet. Die im Sol vorhandenen unerwünschten Ionen werden durch Dialyse entfernt, da diese Ionen das Sol schließlich koagulieren können.
Chemische Methoden:
Oxidationsmethode:
Herstellung von kolloidalem Schwefel:
Wenn H2S in Wasser (wässrige Lösung) der Luft ausgesetzt wird, wird es langsam zu Schwefel oxidiert. Der so gebildete Schwefel verbleibt im kolloidalen Zustand in Wasser und die so gebildete Lösung verbleibt im kolloidalen Zustand in Wasser und die Lösung hat ein leicht milchiges Aussehen.
H2S + O2 → H2O + 2S (kolloidal)
Ein Schwefelsol kann auch hergestellt werden, wenn H2S-Gas durch eine wässrige Lösung von SO2 geblasen wird.
H2S + SO2 → 2 H2O + 3S (kolloidal)
Reduktionsmethode:
Herstellung von Goldsol:
Eine Reihe von Metallen wie Silber, Gold, Platin, Quecksilber Blei kann im kolloidalen Zustand durch Reduktion ihrer Salzlösungen (verdünnt) unter Verwendung geeigneter Reduktionsmittel wie Schwefelwasserstoff, Formaldehyd, Zinnchlorid, Gerbsäure usw. erhalten werden.
Goldsol kann erhalten werden, wenn AuCl3 (dil) -Lösung mit Zinnchlorid behandelt wird.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 Au (kolloidal)
In ähnlicher Weise werden Silber-, Platin-Quecksilbersole hergestellt.
AgNO3 + Gerbsäure → Ag-Sol
AuCl3 + Gerbsäure → Au-Sol
Hydrolysemethode:
Herstellung von Eisenhydroxid-Sol:
Eine kolloidale Lösung von Eisenhydroxid wird durch Kochen einer verdünnten Lösung von Eisenchlorid erhalten.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
Herstellung von Kieselsäuresol:
Durch Hydrolyse einer verdünnten Lösung von Natriumsilikat mit einer Salzsäure wird die kolloidale Lösung von Kieselsäure erhalten.
Doppelte Zersetzungsmethode:
Herstellung von Arsensulfidsol:
Arsensulfid, As2S3 ist ein lyophobes Kolloid. Es wird durch Hydrolyse von Arsenoxid (AS203) mit kochendem destilliertem Wasser erhalten, gefolgt von H2S-Gas durch die erhaltene Lösung. In der kolloidalen Lösung von Arsensulfid ist jedes Teilchen von HS-Ionen umgeben, die durch die Dissoziation von H2S erzeugt werden. Diese Sulfidionenschicht ist ferner von der Gegenionenschicht aus H+-Ionen umgeben.
As2O3 + 3 H2O → 2As (OH)3 (siedend)
2 As (OH)3 + 3H2S → As2S3 + 6H2O
(hellgelbes Sol)
Nach der Austauschlösungsmittelmethode:
Es gibt eine Reihe von Substanzen, deren kolloidale Lösungen hergestellt werden können, indem man ein lösung der Substanz in einem Lösungsmittel und Gießen in ein anderes Lösungsmittel, in dem die Substanz relativ weniger löslich ist.
Herstellung von Schwefel- oder Phosphor-Sol:
Wenn eine in Alkohol hergestellte Schwefel- oder Phosphorlösung in Wasser gegossen wird, wird aufgrund der geringen Löslichkeit von Schwefel oder Phosphor in Wasser eine kolloidale Lösung von Schwefel oder Phosphor erhalten.
Durch Änderung des physikalischen Zustands:
Eine kolloidale Lösung bestimmter Elemente wie Quecksilber und Schwefel wird erhalten, indem ihre Dämpfe durch kaltes Wasser geleitet werden, das einen Stabilisator ( ein Ammoniumsalz oder ein Citrat) enthält.
Methode der übermäßigen Kühlung:
Eine kolloidale Lösung von Eis in einem organischen Lösungsmittel wie Ether oder Chloroform kann durch Einfrieren einer Lösung von Wasser in dem Lösungsmittel hergestellt werden. Die Wassermoleküle, die nicht mehr in Lösung gehalten werden können, verbinden sich getrennt zu Partikeln kolloidaler Größe.
Reinigung kolloidaler Lösung
Dialyse:
Der Prozess der Trennung der Kolloidpartikel von denen des Kristalloids durch Diffusion durch eine geeignete Membran (Tiermembran oder Pergamentpapier) wird als Dialyse bezeichnet. Die zur Durchführung der Dialyse verwendete Vorrichtung wird als Dialysator bezeichnet.
Prinzip:
Die kolloidalen Partikel können eine Pergament- oder Zellophanmembran nicht passieren, während die Ionen des Elektrolyten (Kristalloide) diese passieren können.
Verfahren:
Ein Beutel aus geeigneter semipermeabler Membran, der die kolloidale Lösung enthält, wird in einem Gefäß suspendiert, durch das kontinuierlich frisches Wasser geleitet wird. Die Moleküle und Ionen der Kristalloide diffundieren durch die Membran ins Wasser und werden weggespült. Somit wird das Sol im Beutel gereinigt.
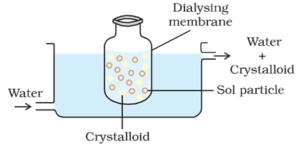
Die Dialyse kann zur Entfernung von HCl aus dem Eisenhydroxidsol verwendet werden.
Elektrodialyse:
Der normale Prozess der Dialyse ist langsam. (ii) Um den Reinigungsprozess zu erhöhen, wird die Dialyse durch Anlegen eines elektrischen Feldes durchgeführt. Dieser Prozess wird Elektrodialyse genannt. Die in der kolloidalen Lösung vorhandenen Ionen wandern zu entgegengesetzt geladenen Elektroden.

Die wichtige Anwendung des Elektrodialyseprozesses in der künstlichen Nierenmaschine, die für die Reinigung des Blutes der Patienten verwendet wird, deren Nieren versagt haben zu arbeiten.
Ultrafiltration:
Die poren von gewöhnlichen filter papier sind große, daher kolloidale partikel pass durch sie leicht. Wenn die Poren des gewöhnlichen Filterpapiers durch Einweichen des Filterpapiers in einer Lösung von Gelatine von Kolloidion (es ist eine Mischung aus 4% Nitrocellulose in Alkohol und Ether) verkleinert und anschließend durch Einweichen in Formaldehyd
gehärtet werden, kann das behandelte Filterpapier kolloidale Partikel zurückhalten und die wahren Lösungspartikel entweichen lassen. Ein solches Filterpapier ist als Ultrafilter bekannt, und der Prozess der Trennung von Kolloiden unter Verwendung von Ultrafiltern ist als Ultrafiltration bekannt.
Die auf Ultrafilterpapier verbliebenen kolloidalen Partikel werden dann mit einem frischen Dispersionsmittel gewaschen, um eine reine kolloidale Lösung zu erhalten.
Ultrazentrifugation:
Bei dieser Methode wird die kolloidale Lösung in eine Hochgeschwindigkeits-Zentrifugalmaschine gegeben. Beim Zentrifugieren setzen sich die kolloidalen Partikel ab. Die Verunreinigungen verbleiben im Zentrifugat und werden entfernt. Die abgesetzten kolloidalen Partikel werden mit dem Dispersionsmedium gemischt, um die kolloidale Lösung wieder zu bilden.