wetenschap > Chemie > colloïden > bereiding van colloïden
in dit artikel zullen wij verschillende methoden voor de bereiding van colloïden bestuderen.
bereiding van Lyofiele Sols:
voor het bereiden van lyofiele sol wordt de gedispergeerde fase rechtstreeks toegevoegd aan het dispersie-medium in koude toestand of door opwarming.
colloïdale oplossingen van zetmeel, lijm, gelatine enz. in water kan worden bereid door deze methode. Oplossingen van colloïdale elektrolyten zoals Zepen en kleurstoffen kunnen ook worden bereid door deze methode.
preparaat van Lyofobe Sols:
voor het bereiden van lyofobe Sols wordt de stof in bulk afgebroken tot deeltjes met colloïdale afmetingen (dispersie) of worden kleinere deeltjes samengevoegd tot deeltjes met colloïdale afmetingen (condensatie). Om de stabiliteit van sol te verbeteren worden bepaalde stoffen aan de sol toegevoegd, de toegevoegde stoffen worden stabilisatoren genoemd.
Dispersiemethoden:
in de dispersiemethode worden grotere deeltjes uitgesplitst naar de colloïdale grootte in het dispersiemedium. Beginnend met het materiaal in massieve vorm, wordt een colloïdale oplossing bereid met behulp van geschikte apparaten om het te desintegreren in deeltjes van colloïdale grootte. Normaal gesproken wordt dit uitgevoerd door fysieke methoden.
mechanische dispersiemethode :
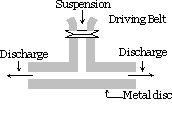
de te verspreiden stof wordt fijngemalen. Het wordt vervolgens gemengd met het dispersie medium, beschermende materialen of stabilisator wordt ook toegevoegd wanneer een grove suspensie wordt verkregen. Deze suspensie wordt dan door een colloïdmolen geleid. Een colloïdmolen bestaat uit twee zware metalen schijven die boven elkaar geplaatst zijn, gescheiden door een heel klein gat van elkaar. Ze worden in tegengestelde richting gedraaid bij een zeer hoge snelheid van ongeveer 7000 toeren per minuut. De sol-resultaten zijn te wijten aan het grote afschuifeffect. Het gebruikte beschermende materiaal voorkomt stolling van deeltjes.
deze methode wordt gebruikt voor indigo, zwavel, tandpasta, inkt, verf, zalven, enz. zijn voorbereid.
Elektrische dispersie of Bredig-boogmethode:
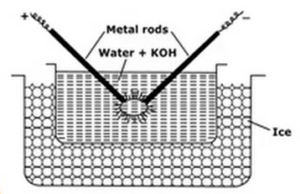
deze methode wordt gebruikt om metalen sols zoals platina, zilver, goud, koper in water voorbereid. Een dispersie medium (geleidbaarheids water) en een spoor van natriumhydroxide (het stabiliserende middel) wordt genomen in porselein of glas (niet-geleidend) vat. Het vat met dispersiemedium is omgeven door een vriesmengsel. Het te verspreiden metaal wordt in het vat ondergedompeld in de vorm van elektroden. Elektroden zijn aangesloten op de hoogspanningsbron. De uiteinden van elektroden in het dispersiemedium liggen zeer dicht bij elkaar. Een zeer hoge spanning wordt toegepast en dan een elektrische boog wordt geslagen tussen de uiteinden van elektroden. Hierdoor ontstaat grote warmte waardoor metalen staven smelten, verdampen en plotseling gekoeld als gevolg van bevriezing mengsel geeft aanleiding tot de colloïdale oplossing van het metaal.
functies van het vriesmengsel zijn
- Invriesmengsel helpt bij de condensatie van metaaldampen die colloïden vormen
- het voorkomt verdamping van water.
- het voorkomt stolling van colloïden door de sol koud te houden.
Peptisatie of chemische dispersie:
Herdispersie van vers bereid precipitaat in de sol door toevoeging van een elektrolyt dat gemeenschappelijk ion bevat, wordt peptisatie genoemd. Een elektrolyt voor peptisatie wordt gebruikt genoemd als peptizing agent. Peptisatie is een omgekeerd proces van coagulatie. De peptisatiewerking is te wijten aan de preferentiële adsorptie van een van de ionen van het elektrolyt op het neerslag.
Voorbeeld 1:
vers bereid Fe (OH)3 precipitaat bij behandeling met een verdunde oplossing van FeCl3, wordt roodbruin ijzerhydroxysol gevormd (Fe3+ is een gewoon ion). In dit geval, is FeCl3 de peptizing agent.
Fe (OH)3 + FeCl3 → Fe3+
Voorbeeld – 2:
vers zilverchlorideprecipitaat bij behandeling met een kleine hoeveelheid verdund HCl wordt een zilverchloridesol gevormd.
Voorbeeld-3:
Cadmiumsulfaat kan met behulp van waterstofsulfaat worden peptiseerd.Ultrasone dispersie:
Ultrasone dispersie:
Ultrasone dispersie is een zeer effectieve verwerkingsmethode voor het genereren en aanbrengen van colloïdale deeltjes. Hoge intensiteit ultrasone golven worden gebruikt voor dit doel. Tijdens het soniceren van vloeistoffen de ultrasone golven die zich voortplanten door middel van dispersiemedium resulteren in afwisselende hoge druk (compressie) en lage druk (zeldzaamheid) cycli. Deze mechanische belasting veroorzaakt ultrasone cavitatie in vloeistoffen. Het creëert hoge snelheid vloeistofstralen tot 1000 km/u. Dergelijke jets druk vloeistof bij hoge druk tussen de deeltjes en scheiden ze van elkaar. Kleinere deeltjes worden versneld met de vloeibare jets en botsen bij hoge snelheden.Verschillende stoffen zoals olie, kwik, zwavel, sulfiden en oxiden van metaal kunnen met behulp van deze methode in colloïdale toestand worden gedispergeerd.
Condensatiemethoden:
deze methoden omvatten chemische reacties. In deze methoden factoren zoals temperatuur, druk, concentraties. etc. goed worden onderhouden. De ongewenste ionen in de sol worden verwijderd door dialyse , omdat deze ionen uiteindelijk de sol kunnen coaguleren.
chemische methoden:
Oxidatiemethode:
bereiding van colloïdale zwavel:
wanneer H2S in water (waterige oplossing) wordt blootgesteld aan lucht, wordt het langzaam geoxideerd tot zwavel. De aldus gevormde zwavel blijft in water in colloïdale toestand en de aldus gevormde oplossing blijft in water in colloïdale toestand en de oplossing heeft een licht melkachtig uiterlijk.
H2S + O2 → H2o + 2S (colloïdaal)
een zwaveloplossing kan ook worden bereid wanneer H2S-gas door een waterige oplossing van SO2 wordt borreld.
H2S + SO2 → 2 H2o + 3S (colloïdaal)
Reductiemethode:
bereiding van goud Sol:
een aantal metalen zoals zilver, goud, platina, kwiklood kunnen in colloïdale toestand worden verkregen door reductie van hun zoutoplossingen (verdund) met behulp van geschikte reductiemiddelen zoals waterstofsulfide, formaldehyde, tinchloride, looizuur enz.
gouden sol kan worden verkregen wanneer AuCl3 (dil) – oplossing wordt behandeld met tin (II) chloride.
2 AuCl3 + 3 SnCl2 → 3 SnCl4 + 2 ae (colloïdaal)
evenzo worden zilveren en platinum kwiksols bereid.
AgNO3 + looizuur → Ag sol
AuCl3 + looizuur → Au sol
Hydrolysemethode:
bereiding van ijzerhydroxide Sol:
een colloïdale oplossing van ijzerhydroxide wordt verkregen door het koken van een verdunde oplossing van ijzerchloride.
FeCl3 + 3H2O → Fe(OH)3 + 3 HCl
Kiezelzuurpreparaat Sol:
door hydrolyse van een verdunde natriumsilicaatoplossing met zoutzuur wordt de colloïdale kiezelzuuroplossing verkregen.
Double Decomposition Method:
Preparation of Arsenious sulfide Sol:
Arsenious sulfide, As2S3 is a lyofobic colloid. Het wordt verkregen door de hydrolyse van arsenisch oxide (AS203) met kokend gedestilleerd water, gevolgd door het passeren van H2S-gas door de verkregen oplossing. In de colloïdale oplossing van arseensulfide is elk deeltje omgeven door HS – ionen, geproduceerd door de dissociatie van H2S. Deze sulfide-ionenlaag wordt verder omgeven door de tegenionenlaag van H+ – ionen.
As2O3 + 3 H2O → 2As(OH)3 (koken)
2(OH)3 + 3H2S → As2S3 + 6H2O
(licht geel sol)
Door Uitwisseling Oplosmiddel Methode:
Er zijn een aantal stoffen waarvan de colloïdale oplossingen kunnen bereid worden door het nemen van een oplossing van de stof in een oplosmiddel en gieten het in een ander oplosmiddel waarin de stof is relatief minder oplosbaar.
preparaat van zwavel-of fosforhoudende Sol:
indien een in alcohol bereide oplossing van zwavel of fosfor in water wordt gegoten, wordt een colloïdale oplossing van zwavel of fosfor verkregen door de lage oplosbaarheid van zwavel of fosfor in water.
door verandering van de fysische toestand:
een colloïdale oplossing van bepaalde elementen zoals kwik en zwavel wordt verkregen door hun dampen door koud water te laten lopen dat een stabilisator ( een ammoniumzout of een citraat) bevat.
Excessieve Koelmethode:
een colloïdale oplossing van ijs in een organisch oplosmiddel zoals ether of chloroform kan worden bereid door een oplossing van water in het oplosmiddel te invriezen. De moleculen van water die niet meer in oplossing kunnen worden gehouden, combineren afzonderlijk om deeltjes van colloïdale grootte te vormen.
zuivering van colloïdale oplossing
dialyse:
het proces van het scheiden van de deeltjes van colloïde van die van kristalloïde, door middel van diffusie door een geschikt membraan (dierlijk membraan of perkamentpapier) wordt dialyse genoemd. Het apparaat dat wordt gebruikt voor het uitvoeren van dialyse wordt dialyser genoemd.
Principe:
de colloïdale deeltjes kunnen niet door een perkament-of cellofaanmembraan, terwijl de ionen van de elektrolyt (kristalloïden) er doorheen kunnen.
procedé:
een zak bestaande uit een geschikt semipermeabel membraan dat de colloïdale oplossing bevat, wordt gesuspendeerd in een vat waar continu zoet water doorheen stroomt. De moleculen en ionen van kristalloïden diffunderen door het membraan in het water en worden weggespoeld. Zo wordt de sol in de zak gezuiverd.
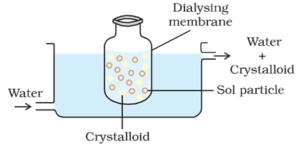
dialyse kan worden gebruikt om HCl uit de ijzerhydroxide sol te verwijderen.
elektrodialyse:
het gewone dialyse-proces verloopt traag. (ii) om het zuiveringsproces te verhogen, wordt de dialyse uitgevoerd door het toepassen van een elektrisch veld. Dit proces wordt elektrodialyse genoemd. De ionen in de colloïdale oplossing migreren naar tegengesteld geladen elektroden.

de belangrijke toepassing van elektrodialyse proces in de kunstnier machine gebruikt voor de zuivering van het bloed van de patiënten van wie de nieren niet hebben gewerkt.
ultrafiltratie:
de poriën van gewoon filtreerpapier zijn groot, waardoor colloïdale deeltjes er gemakkelijk doorheen gaan. Indien de poriën van het gewone filtreerpapier kleiner worden gemaakt door het filtreerpapier in een collodion-oplossing te weken (dit is een mengsel van 4% nitrocellulose in alcohol en ether) en vervolgens worden verhard door formaldehyde
te weken, kan het behandelde filtreerpapier colloïdale deeltjes vasthouden en de echte oplossingsdeeltjes laten ontsnappen. Dergelijk filterpapier staat bekend als ultrafilter en het proces van het scheiden van colloïden met behulp van ultrafilters is bekend als ultrafiltratie.
de colloïdale deeltjes die op ultrafilterpapier achterblijven, worden vervolgens gewassen met een vers dispersie-medium om een zuivere colloïdale oplossing te verkrijgen.
Ultracentrifugatie:
bij deze methode wordt de colloïdale oplossing in een snelle centrifugaalmachine geplaatst. Bij centrifugeren bezinken de colloïdale deeltjes. De onzuiverheden blijven in het centrifugaat achter en worden verwijderd. De vaste colloïdale deeltjes worden met het dispersie-medium gemengd om de colloïdale oplossing opnieuw te vormen.